Adsorption von Biomolekülen
This content is currently available in German only.
Innerhalb dieses Projektes untersuchen wir die Mechanismen der Proteinadsorption an den Grenzflächen fest/flüssig. Hintergund dieses Forschungsbereiches ist die Optimierung der Biokompatibilität von Zahnersatzmaterial. Die Methodik unserer Forschung beinhaltet die Charakterisierung der Proteinadsorption an Oberflächen, die durch Variation von kurz- und langreichweitigen Kräften unterschiedliche Wechselwirkungspotentiale aufweisen. Die physiochemische Zusammensetzung dieser Oberflächen wird sorgfältig kontrolliert und mittels AFM Messungen und Analyse der Benetzungseigenschaften charakterisiert. Hierdurch sind wir auch in der Lage, die Struktur und Grenzflächenspannung der einzelnen Komponenten zu identifizieren. Mittels in situ-Ellipsometrie untersuchen wir nicht nur die Adsorptionskinetik von gereinigten Proteinen, sondern auch die Adsorptionseigenschaften von Proteinmischungen.

Abb.1: Rasterkraftmikroskop-Aufnahme eines adsorbierten Speichelfilms auf einem OTS beschichteten Silizium-Substrat. Das freie Substrat im Vordergrund wurde während der 10 minütigen in vitro Exposition abgedeckt.
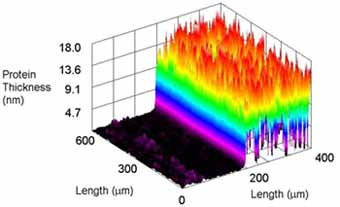
Abb.2:Ellipsometer-Aufnahme derselben Probe.
Adsorption von Bakterien auf Oberflächen
Bakterien kennen wir meist als Krankheitserreger. Was passiert eigentlich, wenn Bakterien auf eine Oberfläche treffen? Es kommt zur Bildung eines Biofilms. Ein typischer Biofilm ist z.B. der eher unerwünschte Zahnbelag, der aus einer Mischung von Bakterien und Proteinen besteht. Biofilme findet man in fast jeder feuchten Umgebung. Problematisch sind diese Filme für gewöhnlich nicht, denn unser Immunsystem hat gelernt, damit umzugehen. Werden jedoch bei chirurgischen Eingriffen Bakterien in den Körper eingeschleust, ist die Gefahr, sich eine gefährliche Krankheit einzuhandeln, enorm hoch, da die Bakterien meist in der feuchten Umgebung hervorragende Bedingungen zur Vermehrung und Biofilmbildung vorfinden. Chirurgische Instrumente und Implantate sollten daher so beschaffen sein, dass im besten Fall keine Bakterien anhaften.
Hier setzen unsere Studien an: Wir untersuchen Eigenschaften, die die Adhäsion von Bakterien an verschiedenartigen Oberflächen beeinflussen.
Wie könnte man die Adhäsionskraft von Bakterien bestimmen? Im Prinzip genauso wie man die Haftkraft eines Klebstreifens bestimmt: man presst den Streifen („das Bakterium“) mit einer bestimmten Auflagekraft auf eine Unterlage („die Oberfläche“), wartet ein paar Sekunden und misst dann die Kraft, die man zum Ablösen aufbringen muss („Adhäsionskraft“).
Bei Bakterien muss man dieses Messprinzip nur etwas verkleinern, vom Millimeter – (10-3 m) auf den Mikrometermaßstab (10-6 m), denn Bakterien sind in etwa 1 μm groß.
Dies gelingt mit dem Rastersondenmikroskop. Hier dient ein kleiner Federbalken als Kraftmesser. Die Bakterien werden an dessen Ende aufgebracht und die Messung durchgeführt, wie zuvor beim Klebestreifen.

Abb.3 und Abb.4
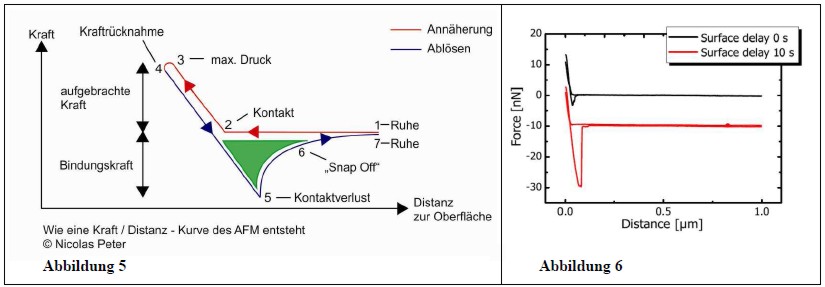
Abb.5 zeigt eine schematische, Abb.6 eine experimentelle Kraft / Distanz – Kurve. Die Adhäsionskraft lässt sich direkt aus diesen Kurven ablesen.
Diese Messmethode eröffnet nun großartige Forschungsmöglichkeiten:
|
Plastik, Glas, Metalle, Oxide, funktionalisierte, etc. |
|
glatt, strukturiert, etc. |
|
gram – positiv, gram – negativ, genmanipuliert, etc. |
|
wässrige Lösung mit verschiedenen Zusätzen, in Gegenwart anderer Bakterien, etc. |
Ein überraschendes Ergebnis ist zum Beispiel, dass die Adhäsionskraft von Bakterien nicht nur von der
chemischen Zusammensetzung der Oberfläche abhängt, sondern auch von der Zusammensetzung unterhalb der
Oberfläche.
Bakterien sind sozusagen sensibel wie die Prinzessin auf der Erbse.

 Deutsche Version
Deutsche Version