Bakterielle Adhäsion
Welche Oberflächen mögen sie besonders?
Welche Eigenschaften sollte ein Material, das für Implantate verwendet wird, idealerweise haben?
Das sind nur einige der vielen Fragen, die wir in unserer Arbeitsgruppe beantworten wollen. Dazu verwenden wir Rasterkraftmikroskopie-basierte Kraftspektroskopie. Als Sonden benutzen wir entweder Bakteriencluster oder einzelne Zellen. In beiden Fällen können wir zeigen, dass die Bakterien während der Experimente “lebendig” sind und auch nicht durch die Messung abgetötet werden.

(Die rot scheinende Zelle wurde abgetötet, während die grün leuchtende Zelle vital ist).
In unseren Experimenten nehmen wir typischerweise Kraft/Distanz-Kurven auf, die uns quantitative, abstandsabhängige Informationen über die Wechselwirkungen zwischen Bakterien und Oberflächen geben. Wir erhalten zm Beispiel die Haftkraft, die sog. Adhäsionsenergie und die Abreißlänge aus den Rückzugkurven der Kraft/Abstands-Messungen. In den Annäherungskurven auf schlecht benetzbaren Oberflächen können wir einen sogenanntes „Snap-in-Event“ beobachten. Dieser Vorgang kann im Bezug auf die maximal auftretende Kraft und den Abstand, bei dem er startet, charakterisiert werden. Neben Kraft/Abstands-Messungen führen wir auch Flusskammer-Experimente durch, die den Vorteil haben, dass viel mehr Zellen gleichzeitig untersucht werden können.
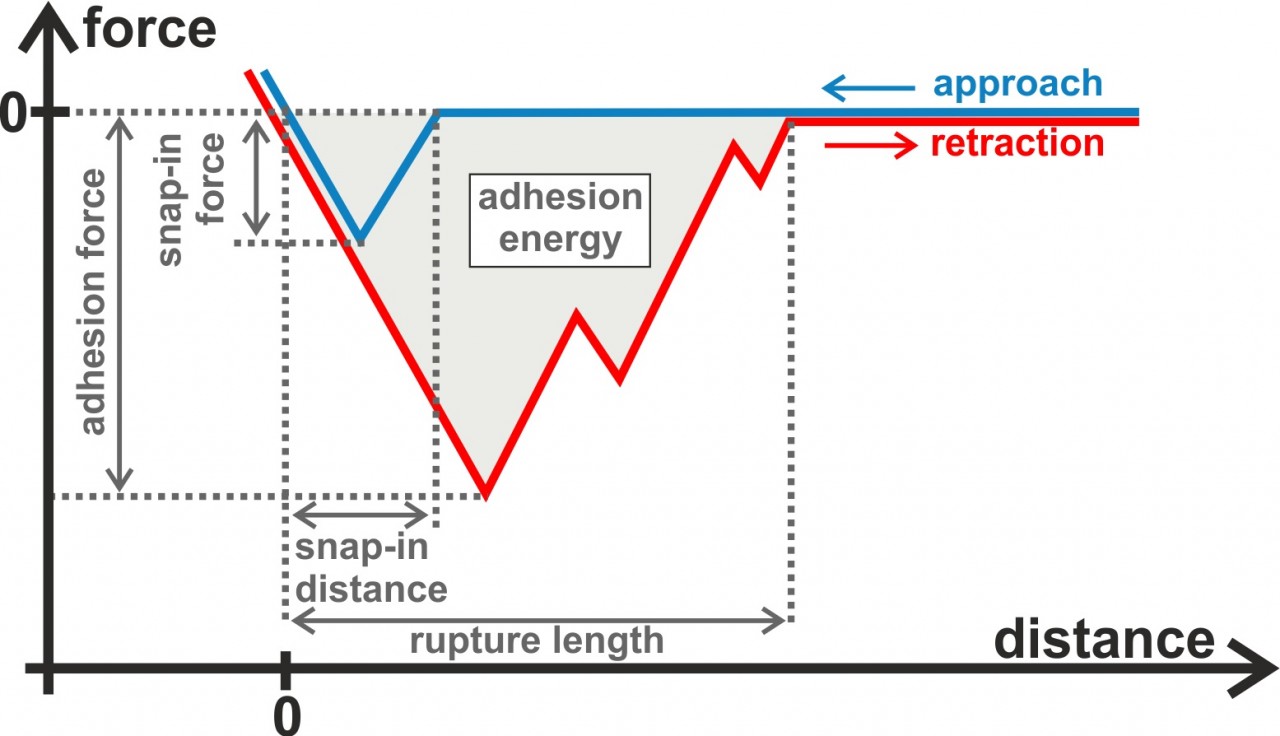
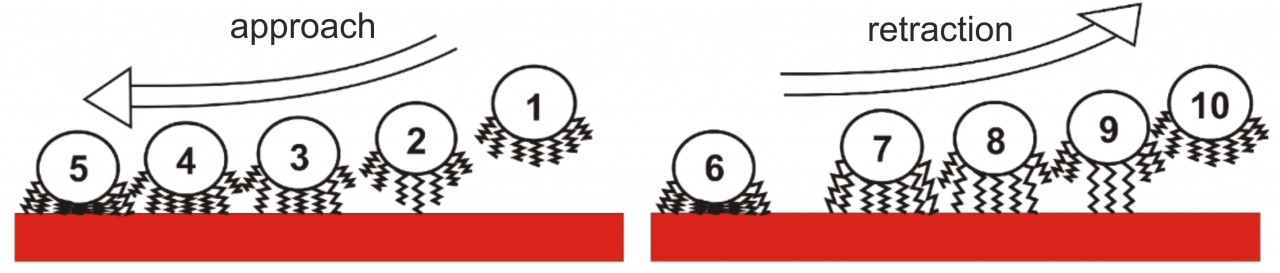
Unsere Experimente haben zu einem neuen Modell der bakteriellen Adhäsion geführt, das darauf beruht, dass die Haftung fast ausschließlich durch an die Oberfläche bindende Makromoleküle der bakteriellen Zellwand vermittelt wird. Wenn ein Bakterium sich einer Oberfläche annähert, haften diese Makromoleküle nacheinander an der Oberfläche an und – wenn genug Moleküle angebunden sind – ziehen das komplette Bakterium zur Oberfläche. Wird die Zelle von der Oberfläche abgelöst, so verlieren die Moleküle nacheinander den Kontakt zur Oberfläche, was zur typischen Form einer Kraft/Abstands-Kurve führt. Mit Hilfe dieses Models konnten die Ergebnisse unserer Experimente in Monte-Carlo-Simulationen quantitativ reproduziert werden.
Unsere Experimente haben auch gezeigt, dass für die Haftfähigkeit von Staphylokokken, wie z. B. S. aureus oder S. carnosus, sowohl kurz- als auch langreichweitige Wechselwirkungen eine Rolle spielen. Beispielsweise haben wir gezeigt, dass die Zellen auf schlecht benetzbaren Oberflächen sehr viel besser haften als auf gut benetzbaren Substraten. Dieses Wissen konnten wir benutzen, um die Kontaktfläche zwischen Staphylokokken und glatten Oberflächen zu bestimmen. Interessanterweise hängt die Größe der Kontaktfläche einer bestimmten Zelle nicht mit ihrer Haftkraft zusammen.
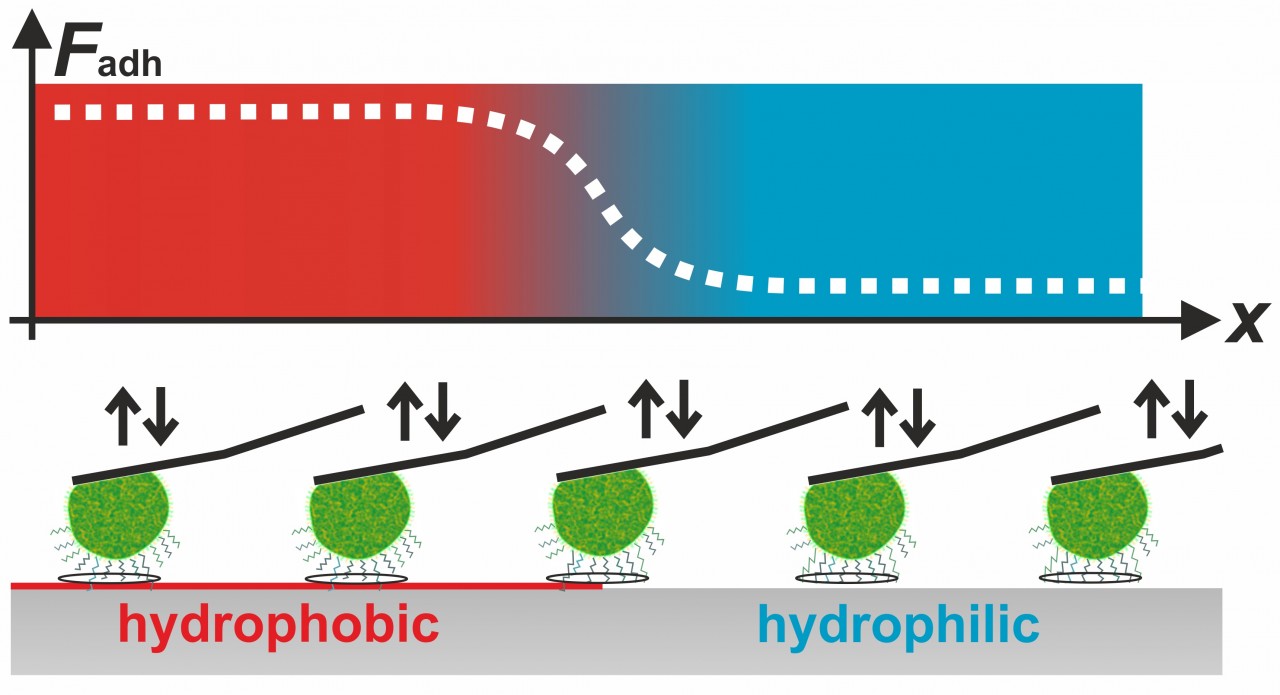
während schrittweise eine Grenze zwischen einem sehr schlecht und einem gut benetzbaren Material überschritten wird, werden kontinuierlich Karft/Distanz-Kurven aufgenommen.
Desweiteren haben wir Experimente mit Streptokokken durchgeführt, bei denen wir uns auf die Haftung an naturnahen Materialien konzentriert haben. Ein Beispiel für ein solches Material ist Hydroxylapatit (HAP), das die mineralische Komponente von Zahnschmelz bildet. In diesen Experimenten konnten wir zeigen, dass sich S. mutans-Zellen ihrem natürlichen Habitat, der Mundhöhle, durch eine Erhöhung ihrer Haftkraft in Speichel anpassen. In einer anderen Studie haben wir gezeigt, dass sich die Haftkraft vierschiedener Bakterien aus der Mundhöhle auf Zähnen reduziert, wenn die Zähne zuvor fluoriert wurden (wie es durch viele Zahnpflegeprodukte geschieht).

 Deutsche Version
Deutsche Version